نویسنده
- 08 مهر 1403
- زمان مطالعه : 5 دقیقه
آزمون مهاجرت سلولی (تست خراش یا اسکرچ)
مهاجرت یک فرآیند مهم است که بر چندین جنبه فیزیولوژیکی تأثیر می گذارد. در ترمیم زخم، مهاجرت باعث تسهیل اپیتلیزه شدن مجدد پوست می شود. در زخم های غیر التیام بخش مانند زخم های مزمن، باکتری های فرصت طلب باعث عفونت زخم می شوند و زخم های باز برای رشد باکتری ها و تشکیل بیوفیلم ایده آل هستند. بیوفیلم یکی از عوامل ایجاد باکتری های مقاوم است که یکی از بزرگترین تهدیدها برای جامعه مدرن ما است. در ترمیم زخم، سلول های ایمنی نمی توانند به بیوفیلم نفوذ کنند. در سرطان، مهاجرت سلول های سرطانی یک مرحله محوری متاستاز است که علت اصلی مرگ بیماران مبتلا به تومورهای جامد است. بنابراین، بسیار مهم است که بتوانیم مهاجرت را مطالعه کنیم.
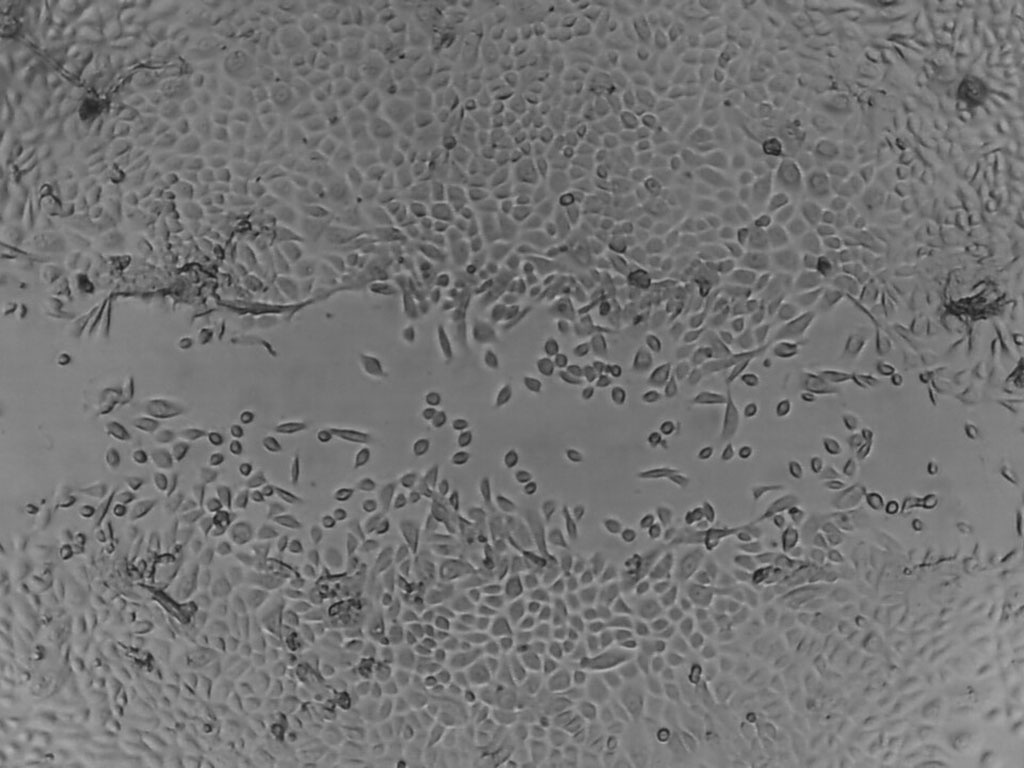
سنجش زخم خراش یک سنجش ساده و قابل تکرار است که معمولاً برای اندازهگیری پارامترهای مهاجرت سلولی مانند سرعت، پایداری و قطبیت استفاده میشود.
آزمایش خراش اغلب برای آزمایش مهاجرت سلولی استفاده می شود، زیرا انجام آن بر روی رده های سلولی چسبنده، مانند خطوط سلولی فیبروبلاست، اندوتلیال و اپیتلیال، ارزان و آسان است. سلول ها رشد می کنند تا به هم متصل شوند و یک "زخم" نازک با خراشیدن با نوک پیپت ایجاد می شود. سلول های لبه زخم قطبی می شوند و به فضای زخم مهاجرت می کنند. مزایای این روش این است که نیازی به استفاده از مواد شیمیایی خاص ندارد و حتی در انواع سلولهایی که در سنجش مهاجرت "تک سلولی" پاسخ محکمی نشان نمیدهند، یک واکنش مهاجرتی جهت دار قوی ایجاد میکند. هنگامی که تصویر برداری با گذشت زمان انجام می شود، می تواند اطلاعات مورفولوژی سلولی/محلی سازی پروتئین را که قابل اطمینان ترین تجزیه و تحلیل است به ما بدهد.
امروزه روشهای مختلفی برای انجام خراشها وجود دارد و از مواد مختلفی استفاده میشود که از جمله آنها میتوان به خلال دندان، خراش سلولی، لیزر و جریان الکتریکی اشاره کرد. همه روش ها مزایا و معایب مختلفی دارند و روش باید با توجه به نوع سلول، بودجه و ابزار تجزیه و تحلیل تصمیم گیری شود به عنوان مثال اگر ایجاد خراش با یک خلال دندان یا نوک پیپت، بر مهاجرت در منطقه تأثیر گذارد، باید از روش متفاوتی استفاده شود. در این مطالعه، ما بر روی خراش دادن دستی تمرکز خواهیم کرد.
نکته منفی خراش دادن دستی، تغییر اندازه، شکل خراش ها و تجمع سلول در لبه های خراش است. پروتکلهای زیادی وجود دارد و مقاله های بسیار مورد استناد به افزایش سرعت و/یا شستشوی کامل پس از خراش دادن توصیه میکنند. علاوه بر این، چندین روش برای به حداقل رساندن تکثیر استفاده شده است، زیرا تکثیر سلول ها را نمی توان از مهاجرت متمایز کرد و بنابراین ممکن است نتایج مثبت کاذب مهاجرت را به همراه داشته باشد. برخی از روش های گزارش شده عبارتند از حدف سرم قبل از ایجاد خراش و کاهش مقدار سرم. با این حال، هیچ یک از این روش ها نمی تواند تضمین کند که تکثیر وجود نداشته باشد. بنابراین، ما قبل از ایجاد خراش ، سلول ها را با میتومایسین C تیمار کرده تا با اطمینان بیشتر نتایج واقعی مهاجرت را گزارش کنیم. میتومایسین C یک آنتی بیوتیک است که با ایجاد پیوند کووالانسی با DNA، سنتز DNA را مهار می کند، که از جدا شدن DNA جلوگیری می کند. تیمار با میتومایسین C و شستشو با PBS قبل از خراش، مهاجرت واقعی سلول ها را کامل نشان می دهد.
همه روش ها نیاز به سیستمی برای تجزیه و تحلیل فرآیند مهاجرت دارد. یک روش معمول و ارزان برای تجزیه و تحلیل پیشرفت مهاجرت، استفاده از یک میکروسکوپ نوری برای گرفتن تصاویر از خراش در نقاط مختلفی از پیش تعیین شده، و سپس تجزیه و تحلیل بسته شدن شکاف در یک نرم افزار تصویر است.
روش کار
- سلول های مورد نظر را در محیط DMEM با 10% FBS و 1 % آنتی بیوتیک (پنی سیلین و استرپتومایسین) در یک فلاسک T75 رشد دهید.
- سلول های چسبنده در فلاسک را با افزودن ۵ میلی لیتر PBS استریل به فلاسک T75 بشویید. PBS را به گردش در آورید و با پیپت آن را دور بریزید.
- ۱ میلی لیتر تریپسین را به فلاسک اضافه کنید و آن را در سراسر فلاسک سلولی پخش کنید.
- فلاسک را در دمای ۳۷ درجه سانتی گراد در انکوباتور معمولی انکوبه کنید تا زمانی که سلول ها جدا شوند (۵ تا ۸ دقیقه برای اکثر رده های سلولی کافی است).
- زیر میکروسکوپ مشاهده کنید. هنگامی که سلول ها جدا شدند، ۹ میلی لیتر از محیط کشت معمولی را با 10% FBS اضافه کنید تا تریپسین غیرفعال شود.
- تعداد سلول ها را با هموسیتومتر، شمارنده یا مشابه آن بشمارید.
- 2.5×104 سلول در چاهک را در 250 میکرولیتر محیط کشت 10% FBS به یک پلیت کشت بافت ۴۸ چاهکی انتقال دهید. توجه: سنجش را می توان در پلیت های ۶، ۱۲، ۲۴ یا ۹۶ چاهکی نیز تنظیم کرد.
- به آرامی صفحه را از یک طرف به طرف دیگر حرکت دهید تا مطمئن شوید که سلول ها به طور مساوی در چاهک ها پخش می شوند، در غیر این صورت سلول ها در مرکز چاهک ها جمع می شوند. زیر میکروسکوپ نوری بررسی کنید تا مطمئن شوید که سلول به طور یکنواخت در محیط پخش شده اند.
- پلیت را در یک انکوباتور معمولی CO2 دار در دمای ۳۷ درجه سانتیگراد در طول شب یا تا زمانی که سلول ها به کف چاهک ها بچسبند قرار دهید.
- ۱۰ میکروگرم بر میلی لیتر میتومایسین C را در مقدار مناسبی از محیط کشت تهیه کنید.
- محیط مصرف شده را با پیپت پاستور از هر چاه خارج کنید.
- ۲۵۰ میکرولیتر از ۵ میکروگرم بر میلی لیتر میتومایسین C را به هر چاهک اضافه کنید.
- پلیت را به مدت ۲ ساعت انکوبه کنید.
- محیط را خارج کنید.
- چاهک ها را با ۲۵۰ میکرولیتر PBS شستشو بدهید.
- با یک نوک پیپت زرد به صورت عمودی یک خراش دهید. برای هر چاهک از نوک پیپت جدید استفاده کنید.




