نویسنده
- 07 مهر 1403
- زمان مطالعه : 7 دقیقه
تکنیک Transwell Assay چیست؟

مهاجرت و تهاجم سلولی هم در فیزیولوژی طبیعی و هم در بیماری ها نقش اساسی دارد. به این علت، روشهایی برای ارزیابی مهاجرت سلولی و تهاجم سلولی در فرآیندهای طبیعی سلولی و مکانیسمهای بیماری ها ضروری می باشد . در اینجا، ما روش متداول transwell در شرایط آزمایشگاهی را برای مطالعه مهاجرت و تهاجم سلولی شرح می دهیم.
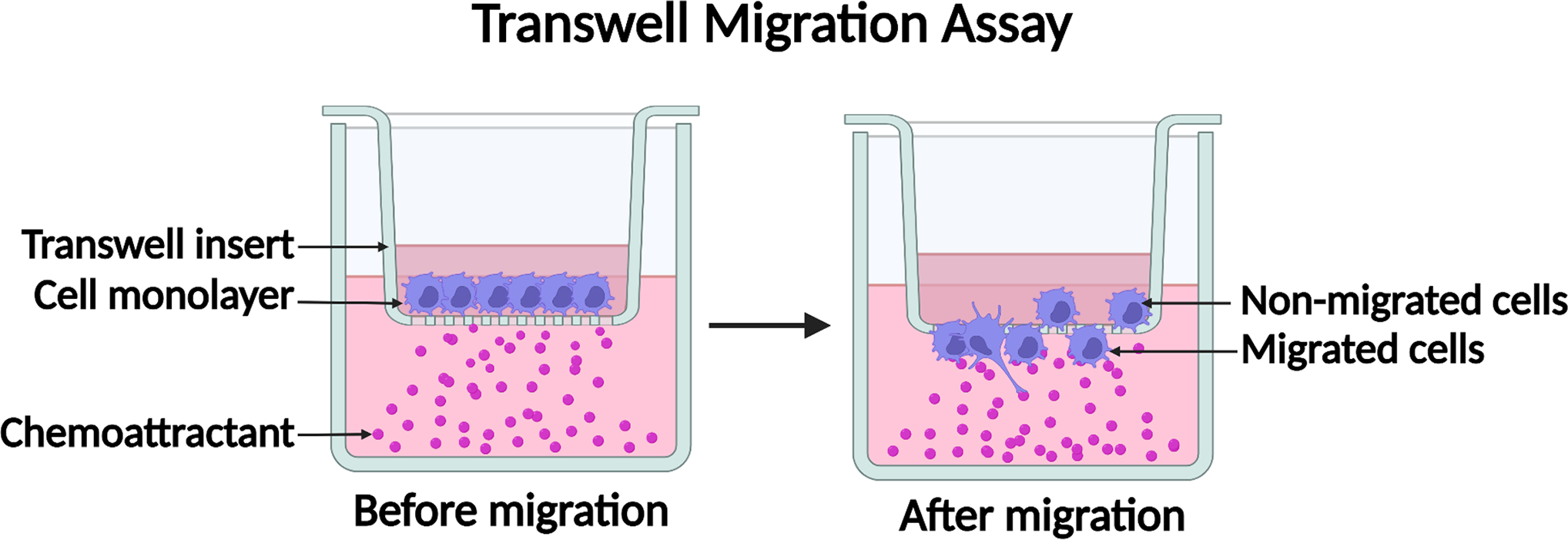
سنجش مهاجرت transwell شامل کموتاکسی سلول ها از طریق یک غشای متخلخل پس از ایجاد یک گرادیان شیمی-جذب کننده (chemotaxis) در محیط می باشد. روش سنجش تهاجم (Transwell assay) شامل افزودن یک ماتریکس خارج سلولی در بالای غشای متخلخل است که تنها به کموتاکسی سلول هایی که دارای خواص تهاجمی مانند سلول های تومور هستند اجازه عبور می دهد.
مهاجرت سلولی در سلول هایی مانند لکوسیت ها، سلول های بنیادی، فیبروبلاست ها و سلول های توموری در انواع فرآیندهای فیزیولوژیکی و پاتوفیزیولوژیکی دخیل هستند. به این ترتیب، سنجش مهاجرت و تهاجم سلولی به طور گسترده ای مورد استفاده قرار گرفته و تأثیر قابل توجهی در زمینه های زیست شناسی و زیست پزشکی داشته است.
سنجشهای متعددی برای ارزیابی مهاجرت یا پاسخ کموتاکتیک به سمت یک ماده ی شیمیایی جاذب مانند کموکاینها، لیپیدهای زیست فعال یا فاکتورهای رشد وجود داشته و توسعه یافتند.
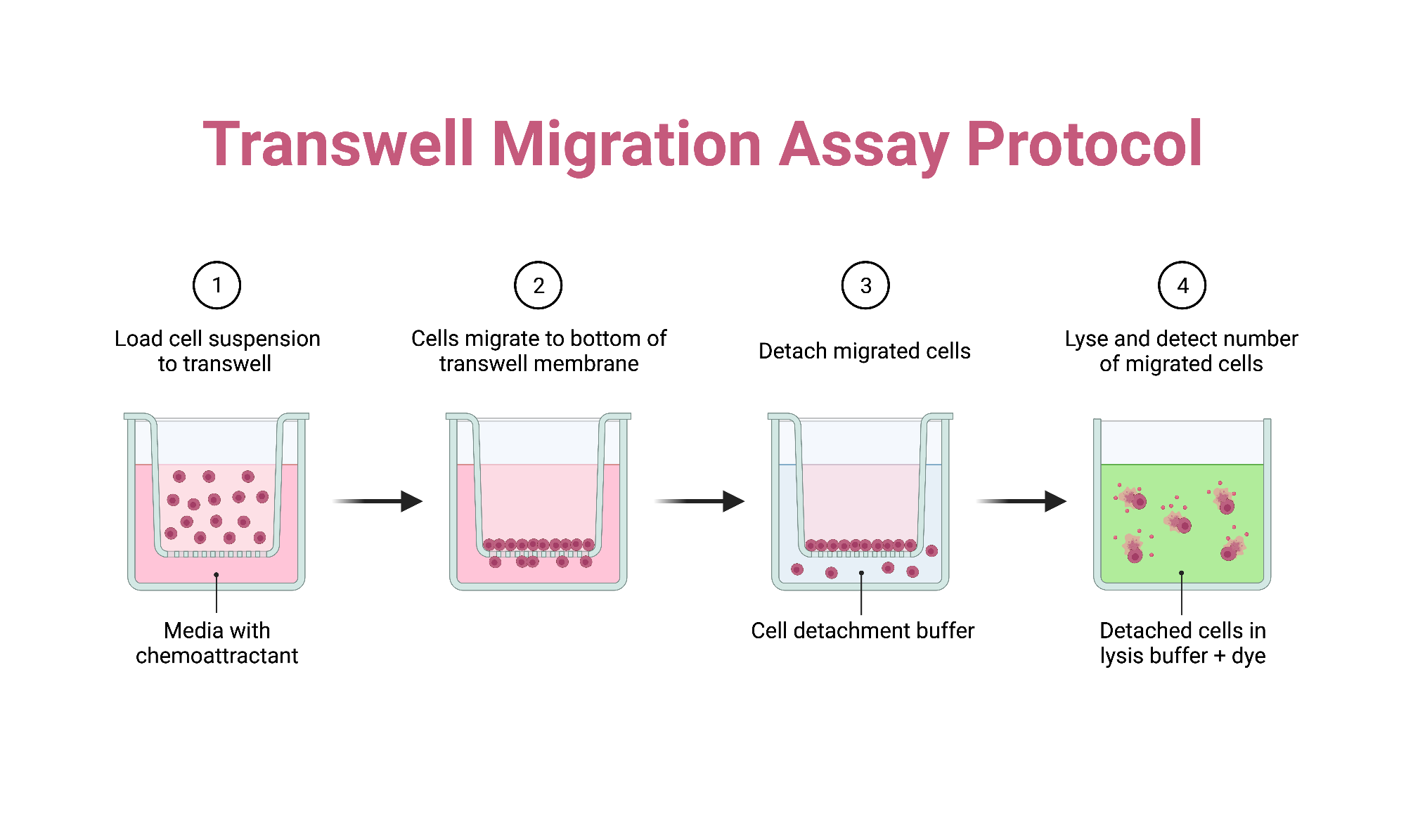
در اینجا، روشهای مهاجرت و تهاجم که به طور گسترده مورد استفاده قرار می گیرند را بیان میکنیم که شامل دو محفظه پر از حفره (chamber) است که توسط یک غشای متخلخل تقسیم میشوند. محیط حاوی عامل مواد شیمیایی جاذب به محفظه پایینی اضافه میشود و سپس سلولها در محفظه بالایی کشت میشوند تا یک گرادیان شیمی-جذب کننده برای مهاجرت سلولی جهت دار ایجاد شود. پس از انکوباسیون، میزان کموتاکسی سلولی را می توان با تعیین کمیت سلول های چسبنده که به سمت پایه غشای متخلخل مهاجرت کرده اند، ارزیابی کرد. علاوه بر این، مهاجرت سلولهای غیرچسبنده به محفظه پایینی را می توان اندازهگیری کرد. برای سنجش مهاجرت و تهاجم ، افزودن یک لایه ماتریکس خارج سلولی در بالای چاهک متخلخل، امکان بررسی تهاجم و مهاجرت سلولی را فراهم می کند.
روش کار
- قبل از شروع پروتکل آزمایشی، سلول ها را برای سنجش مهاجرت سلولی از طریق کشت تا ۸۰ تا ۹۰ درصد کانفلوئنسی در یک پلیت کشت بافت یا یک فلاسک کشت بدهید.
- برای سلولهای غیر چسبنده، محلول سلولی ۱۰ میلیلیتری را در یک لوله فالکون مخروطی ۱۵ میلیلیتری پیپت کنید و از مرحله ۷ به بعد ادامه دهید.
- برای سلول های چسبنده، محیط کشت را از فلاسک کشت سلولی آسپیره کنید و به آرامی ۵ میلی لیتر سالین بافر فسفات (PBS) بدون کلسیم و منیزیم در دمای اتاق (RT) بدون کلسیم و منیزیم به دیواره داخلی صفحه کشت سلول اضافه کنید، به آرامی بچرخانید تا کل صفحه را بپوشاند. آسپیره کنید و ۵ میلی لیتر PBS دیگر را برای شستشوی اضافی اضافه کنید.
- محلول PBS را از پلیت یا فلاسک کشت خارج کنید، ۲ میلی لیتر Trypsin-EDTA 0.25% اضافه کنید و به آرامی بچرخانید تا تریپسین کل صفحه را بپوشاند.
- پلیت یا فلاسک کشت سلولی را در انکوباتور با دمای ۳۷ درجه سانتی گراد و 5% CO2 قرار دهید و به مدت ۳ دقیقه یا تا زمانی که سلول ها از صفحه جدا شوند انکوبه کنید.
- پلیت و یا فلاسک کشت سلولی را از انکوباتور خارج کنید، 3 میلی لیتر محیط گرم شده حاوی ۱۰ درصد سرم جنین گاوی (FBS) را به فلاسک اضافه کنید، به آرامی پیپت کنید تا سلول ها بیشتر از کف فلاسک کشت جدا شوند و سوسپانسیون تک سلولی درست کنید. محلول سلولی 5 میلی لیتری را به یک لوله فالکون سانتریفیوژ مخروطی ۱۵ میلی لیتری منتقل کنید.
- لوله فالکون را به مدت 5 دقیقه با دور ۱۵۰۰ RPM سانتریفیوژ کنید تا پلت سلولی (رسوب) تشکیل شود.
- محلول رویی را دور ریحته تا رسوب سلولی دست نخورده باقی بماند و متعاقباً لوله فالکون را تکان دهید تا رسوب سلولی شل شود.
- 5 میلی لیتر PBS یا محیط کشت کامل را به لوله فالکون اضافه کنید و به آرامی پیپت کنید تا سلول ها مخلوط شوند. مراحل ۶ و ۷ را تکرار کنید.
- بافر مهاجرت را اضافه کرده و به آرامی پیپت کنید تا محلول سلولی مخلوط شود.
- 15 میکرولیتر از محلول سلولی را در 15 میکرولیتر تریپان بلو ، ۴ تا ۵ بار با پیپت بالا و پایین کنید تا محلول مخلوط شود و ۱۰ میکرولیتر را با دقت به هموسیتومتریا لام نئوبار انتقال دهید. سلول های زنده و مرده را محاسبه کنید. سلول های زنده را مجدداً به غلظت ۱ × ۱۰۶ cells/mL در بافر مهاجرت معلق کنید.
- محلول سلولی ۱۰۰ میکرولیتری حاوی ۱۰۵ × ۱ سلول را به دقت روی غشاء داخل چاهک های پلیت (اندازه منافذ ۵ یا ۸ میکرومتر) پیپت کنید و به مدت ۱۰ دقیقه در دمای ۳۷ درجه سانتی گراد و ۵ درصد CO2 انکوبه کنید.
- 600 میکرولیتر از بافر مهاجرت حاوی مواد شیمیایی جذب کننده (chemoattractant) را به چاه مستقیماً در زیر چاهک اضافه کنید.
- پلیت را در دمای ۳۷ درجه سانتی گراد و ۵ درصد CO2 به مدت ۲ تا ۵ ساعت انکوبه کنید.
- پلیت را از انکوباتور خارج کنید.
- با استفاده از یک اپلیکاتور با نوک پنبه، به آرامی سلولهای مهاجرتنشده را از سمت بالایی غشای ورودی transwell جدا کنید. این کار را تکرار کنید تا مطمئن شوید سلولهای که مهاجرت نکردن باقی نماده است.
- محیط کشت را کامل و به آرامی خارج کنید.
- تثبیت و رنگ آمیزی سلول های مهاجرت شده در آخرین مرحله